Kontrollierte Nutzung freiwerdender Energie
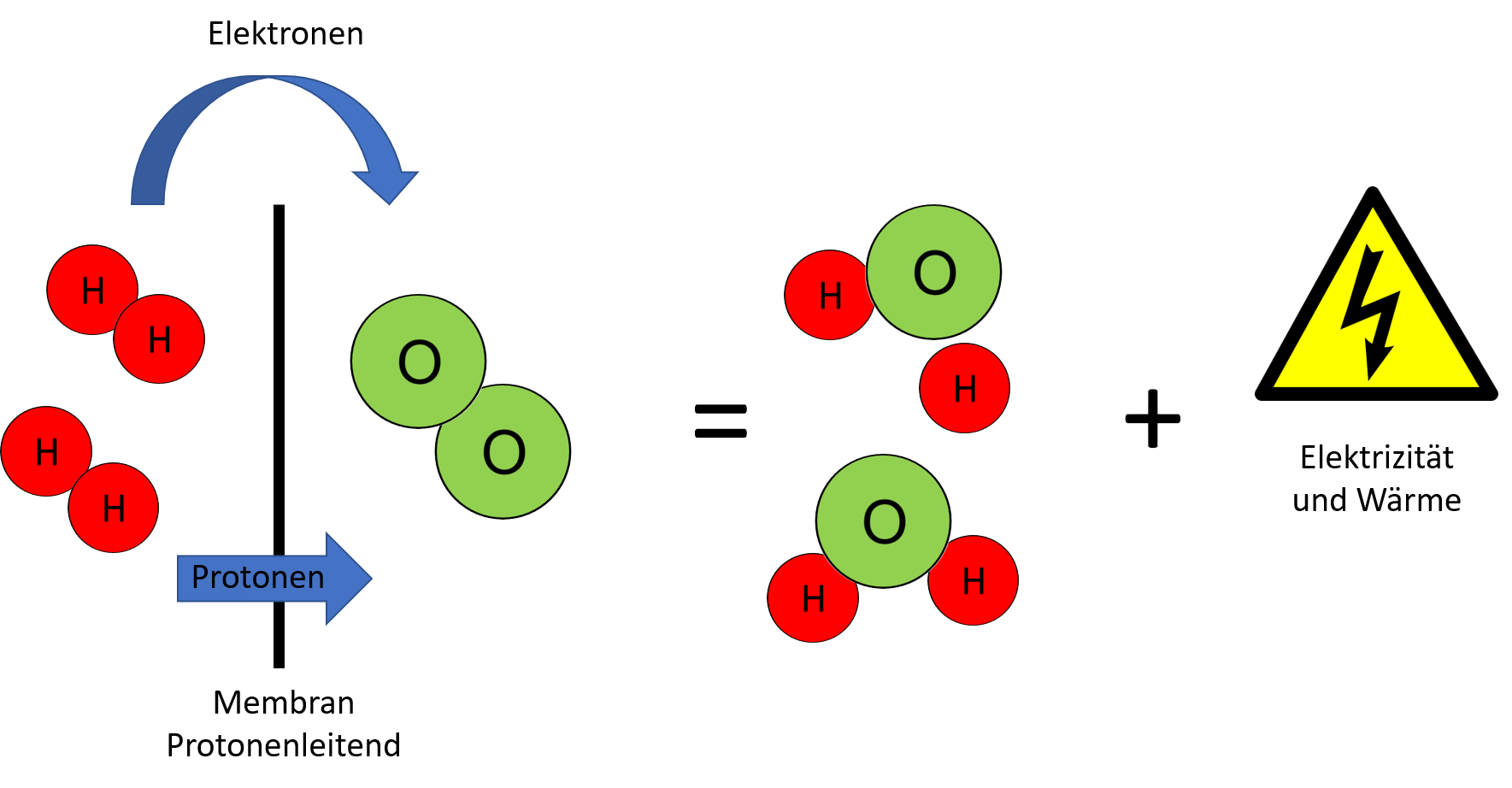
Wenn die Moleküle der beiden gasförmigen Stoffe Wasserstoff und Sauerstoff miteinander reagieren, wird Energie freigesetzt. Sauerstoffatome ziehen Elektronen stärker an als Wasserstoffatome. Das bringt eine Kettenreaktion in Gang, bei der schlagartig viel Energie frei wird. Im Knallgasversuch wird dies anschaulich demonstriert. Die Elektronen der Wasserstoffatome werden zu den Sauerstoffatomen übertragen und es entsteht Wasser. Reaktionen, bei denen Elektronen übertragen werden, nennt man Redoxreaktionen. Sauerstoffatome nehmen jeweils zwei Elektronen auf, sie werden reduziert, und Wasserstoffatome geben jeweils ein Elektron ab, sie werden oxidiert. Im Knallgasversuch verpufft die freigewordene Energie als Wärme. Die Energie kann aber auch genutzt werden, wenn die Redoxreaktion kontrolliert in einer Brennstoffzelle abläuft. Der Elektronenfluss wird hier genutzt, um elektrischen Strom zu erzeugen.
Aufbau und Funktion
Aufbau einer Brennstoffzelle:
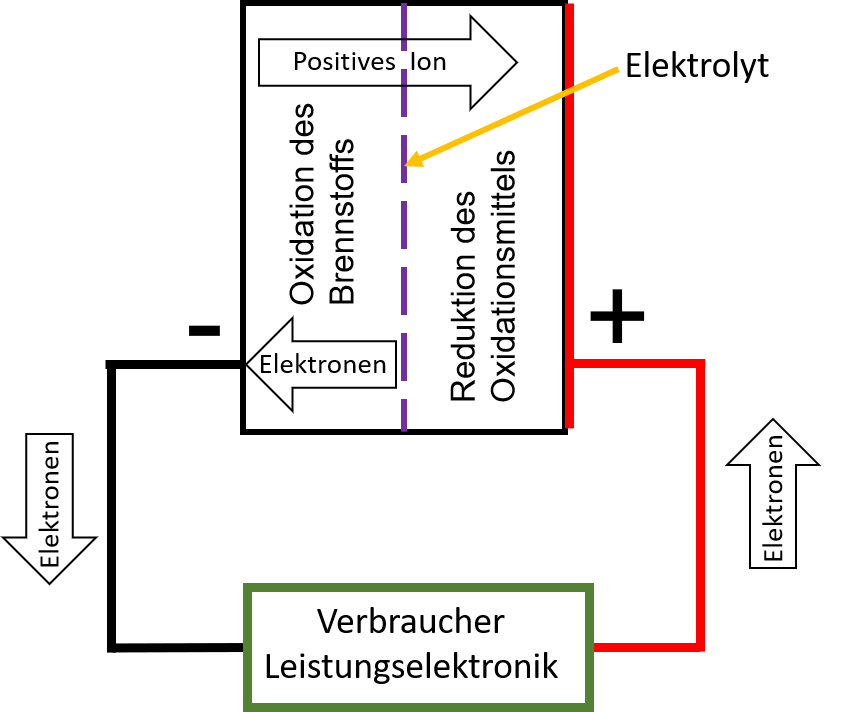
Eine Brennstoffzelle besteht aus Elektroden, die durch eine Membran oder einen Elektrolyt (Ionenleiter) voneinander getrennt sind. Die Anode ist mit dem Brennstoff umspült (zum Beispiel Wasserstoff, Methan, Methanol oder Glukoselösung), der dort oxidiert wird. Die Kathode ist mit dem Oxidationsmittel umspült (zum Beispiel Sauerstoff, Wasserstoffperoxid oder Kaliumthiocyanat), das dort reduziert wird. Die auf der Anodenseite frei gewordenen Elektronen durchlaufen einen externen Stromkreis und erzeugen so elektrische Arbeit.
Funktion einer Brennstoffzelle:
Der Brennstoff wird an der Anode katalytisch oxidiert und dabei unter Abgabe von Elektronen in Ionen umgewandelt. Diese gelangen durch den Elektrolyt in die Kammer mit dem Oxidationsmittel. Die Elektronen werden aus der Brennstoffzelle abgeleitet und fließen über einen elektrischen Verbraucher, z. B. eine Glühlampe, zur Kathode. An der Kathode wird das Oxidationsmittel durch Aufnahme der Elektronen zu Anionen reduziert und reagiert gleichzeitig mit den durch den Elektrolyt zur Kathode gewanderten positiven Ionen zu Wasser.
Aufbau und Funktion beim PKW
Brennstoffzelle im PKW:
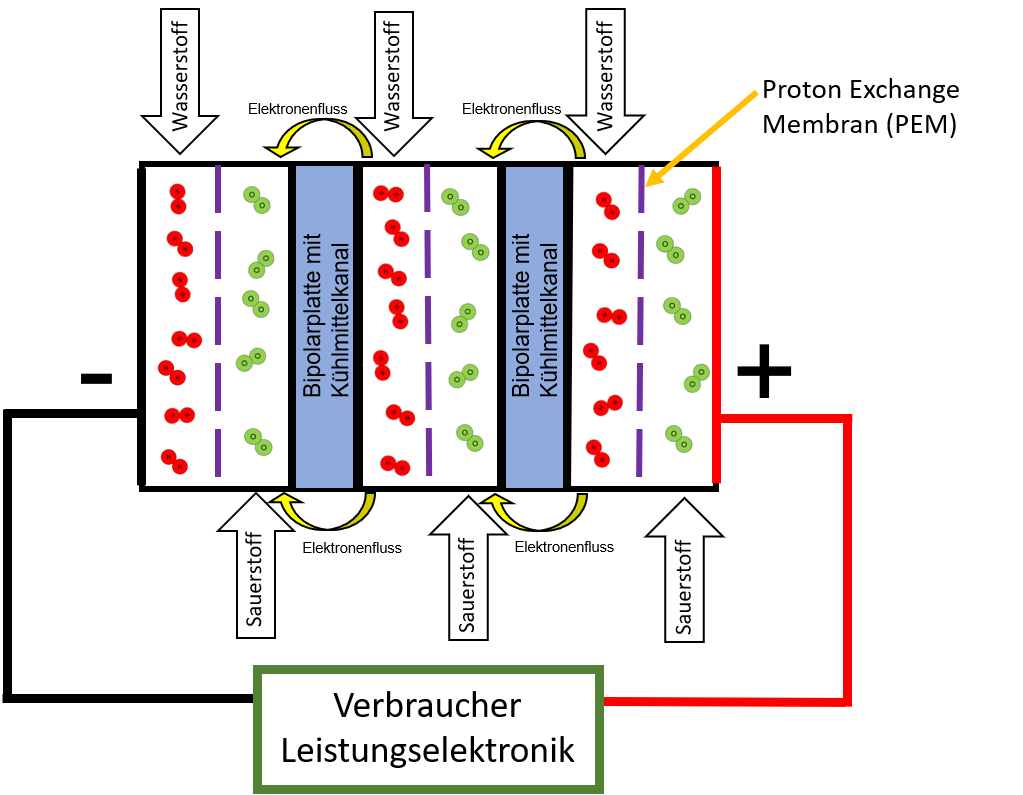
In Kraftfahrzeugen werden PEMFC-Brennstoffzellen (Polymer Electrolyte Membrane Fuel Cell oder Proton Exchange Membrane Fuel Cell) verwendet. Bei dieser Art der Brennstoffzelle ist der protonenleitende Elektrolyt eine Proton Exchange Membran (PEM). Als Brennstoff wird reiner Wasserstoff H2 getankt. Als Oxidationsmittel, auf der anderen Seite der PEM, dient Sauerstoff O2 aus der gefilterten Umgebungsluft.
Der Brennstoff Wasserstoff wird der Anode über Strömungsprofile zugeführt. Die Anode ist mit einem Katalysator, z. B. Platin oder Palladium, versehen. Dadurch erhöht sich die Reaktionsgeschwindigkeit und die Aktivierungsenergie für die Oxidation (Elektronenabgabe) des Wasserstoffmoleküls wird herabgesetzt. Das H2-Molekül wird durch diese katalytische Oxidation in seine einzelnen Atome zerlegt und diese anschließend in das positiv geladene Proton H+ und ein Elektron aufgespalten. Dieses Proton reagiert sofort an dem mit Wasser befeuchteten Elektrolyten zu einem H3O+-Teilchen (Oxoniumion):
Oxidation/Elektronenabgabe: 2H2 + 4H2O → 4H3O⁺ + 4e⁻
Das Oxoniumion H3O⁺ gelangt über den Elektrolyten bzw. die Ionen-Austausch-Membran auf die andere Seite durch die Proton Exchange Membran in die Kammer mit dem Oxidationsmittel O2. Die abgegebenen Elektronen werden jedoch aus der Brennstoffzelle über einen externen Stromkreis abgeleitet und fließen über einen elektrischen Verbraucher zur Kathode, also nicht durch die Membran. Dadurch wird die elektrische Energie für den Fahrzeugantrieb bereitgestellt.
An der ebenfalls katalytischen Kathode wird angefeuchtete Luft zugeführt. Das Oxidationsmittel Sauerstoff aus der Luft wird durch die katalytische Kathode in seine Atome zerlegt und durch Aufnahme der über diesen Umweg gewanderten Elektronen zu Oxid-Anionen reduziert. Die durch den Elektrolyt zur Kathode gewanderten Oxoniumionen 4H3O+ reagieren dann mit den negativen Oxidionen zu Wasser:
Reduktion/Elektronenaufnahme: O2 + 4H3O+ + 4e- → 6H2O
Insgesamt ergibt sich folgende Gesamtreaktionsgleichung:
Redoxreaktion/Gesamtreaktion: 2H2 + O2 → 2H2O + Energie
Die gelieferte Spannung dieser Zellbauart liegt theoretisch bei 1,23 Volt pro Zelle. In der Praxis werden jedoch nur Spannungen von 0,5 bis 1 V erreicht. Die Spannung ist vom Brennstoff, von der Qualität der Zelle und von der Temperatur abhängig. Unter Last bewirken die chemischen und elektrischen Prozesse ein Absinken der Spannung.

Abbildung: PEMFC-Brennstoffzelle
PEM-Membran
Die Proton Exchange Membran, kurz PEM, ist eine Polymermembran und das Herzstück der Brennstoffzelle. Damit die Membran funktioniert, muss sie im Betrieb immer befeuchtet sein. Die eingeblasene Luft wird deshalb vorher angefeuchtet.
Die Membran ist gasdicht, um eine direkte Reaktion von Sauerstoff und Wasserstoff zu verhindern. Diese ist für Elektronen nicht passierbar und somit elektrisch nicht leitend.
Der Kern des Wasserstoffatoms, das Proton, kann jedoch durch die Membran hindurchwandern. Die Membran lässt eine Reaktion bestimmter Wasserstoff- und Sauerstoffteilchen zu, allerdings können die Elektronen des Wasserstoffatoms nicht durch die Membran hindurch und müssen über die Anode und den Verbraucher zur Kathode, um dort die Oxidation zu vervollständigen.
Auf beiden Seiten der Membran ist eine Reaktivschicht, die als Katalysator dient. Zwischen der Membran und den Elektroden ist ein poröses Carbon Papier verbaut.

Abbildung: PEM Membran
Bipolare Platten
Eine Hauptfunktion der Bipolarplatte ist das gleichmäßige Verteilen der Prozessgase Wasserstoff und Sauerstoff über die chemisch aktive Plattenfläche. Dazu sind in die Platten Strömungsprofile eingepresst.
Innerhalb des Stapels werden die an der Wasserstoffseite (Anode) erzeugten Elektronen über die Bipolarplatte geleitet und stehen so den Sauerstoffionen der Luftseite (Kathode) der nächsten Zelle zur Verfügung. Um die elektrischen Verluste gering zu halten, muss der Werkstoff für die Bipolarplatten aus einem sehr guten elektrischen Leiter bestehen.
Die Brennstoffzelle nutzt den Brennstoff mit einem Wirkungsgrad von ca. 60%. Das heißt aber auch, dass 40% der Energie in Wärme anfällt. Diese Wärme muss im Betrieb kontinuierlich durch die angestrebte kompakte Bauweise des Stapels mit Hilfe der Bipolarplatten abgeführt werden. Eine Möglichkeit der Wärmeabfuhr ergibt sich bei einer zweiteiligen Platte, sodass ein kompletter Wärmetauscher integriert ist. Das Kühlmittel strömt zwischen den einzelnen Zellen hindurch.
Brennstoffzellen-Stack
Die Bipolarplatten ermöglichen eine Reihenschaltung aller Brennstoffzellen zu einem Stack. Die Spannung jeder einzelnen Zelle addiert sich, sodass eine Spannung von mehreren hundert Volt an den Enden eines Stacks anliegt. (Bild Reihenschaltung) Die elektrische Leistung wird links und rechts am Stack abgegriffen und nach oben zu einem Steckergehäuse geführt. (Bild Stack)
Leistung, Effizienz und Lebensdauer hängen maßgeblich vom verwendeten Brennstoff und der Art der eingesetzten Brennstoffzelle ab. Generell besteht ein Zusammenhang zwischen Größe des Brennstoffzellstapels (Stack) und Leistung. Bei Brennstoffzellen im PKW kann man mit einem Wirkungsgrad von bis zu 60% rechnen.
Technische Daten des Hyundai Nexo Brennstoffzellenstacks: (Bild Stack)
| Brennstoffzellenanzahl | 440 |
| Brennstoffzellendichte | 3,1 [kW/l Volumen] |
| Brennstoffzelle Ausgangsleistung | 95 [kW] |
| Wirkungsgrad | 60 [%] |